第六版:生物工程
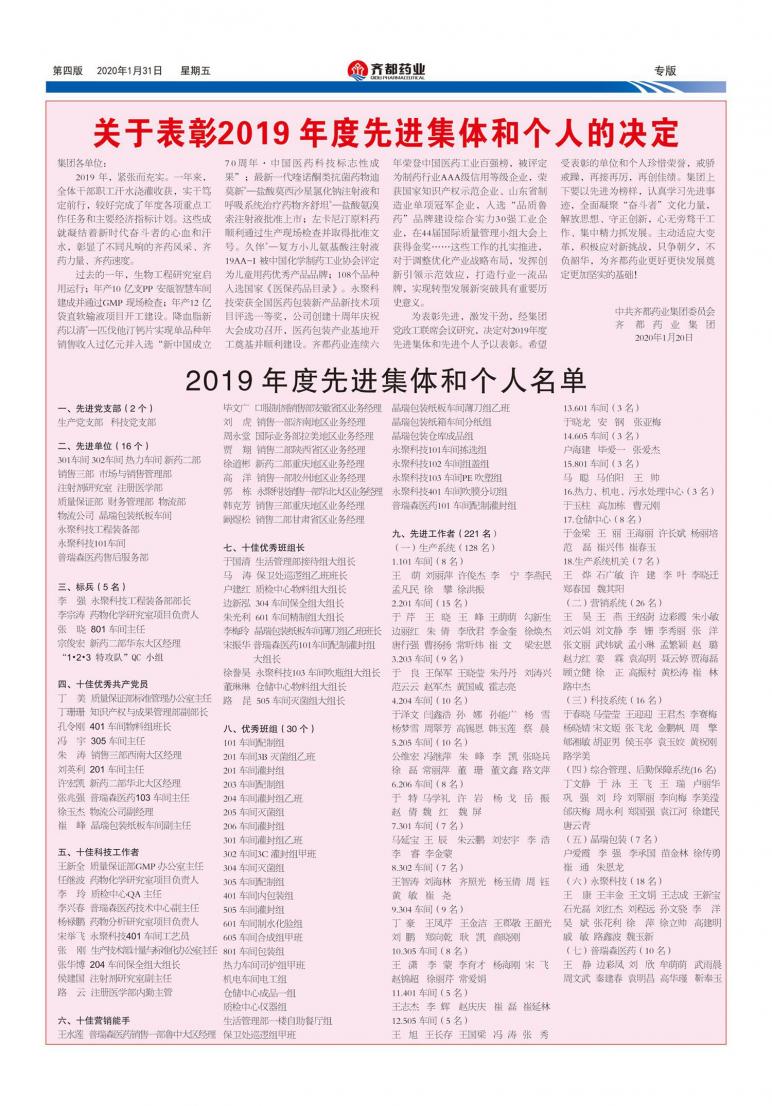
01修复错误编码基因-疾病举例:SMA
脊髓性肌肉萎缩症是一种常见的常染色体隐性神经肌肉病,患者脊髓内的运动神经元受到侵害,会逐渐丧失包含呼吸、吞咽的各种运动功能(不能动、不能进食、直至不能呼吸),是导致婴幼儿死亡的头号遗传疾病之一。目前在美国上市的唯一治疗药物Spinraza (Nusinersen)尚未进入中国,治疗费用也非常昂贵。在今年5月份刚刚发表的文献中,中南大学梁德生团队,通过SMA病人来源的体细胞诱导成包含了病人特异的突变位点的iPSC,利用高特异性的CRISPR/Cpf1基因编辑技术,将SMN2基因进行定点编辑,使其可编码正常的SMN蛋白。在实验中,编辑后的iPSCs分化成的运动神经元,恢复了SMN的表达和正常分布,并且运动神经元形成神经肌肉接头的能力也得到改善。
02移除致病基因-疾病举例:线粒体病
线粒体病具有异质性特点,变异和正常的线粒体环往往同时存在。科学家们想到,可以利用基因编辑工具,切断突变的mtDNA,让线粒体自动清除它们。同时为了保持线粒体内DNA数量的稳定,新的mtDNA又会合成,正常的mtDNA就有机会变得更多。2018年9月,来自剑桥大学Michal Minczuk和Payam Gammage团队和迈阿密大学米勒医学院的Carlos Moraes和Sandra Bacman团队,在《Nature Medcine》杂志上发表研究,表明了利用基因编辑技术靶向切断突变mtDNA,直接在小鼠体内验证了这一基因治疗思路的可行性,均表示考虑开启人体临床试验。 03将缺失的基因插入基因组-疾病举例:HB
B型血友病(HB)传统的基因治疗一般通过外源表达F9因子进行疾病改善。但是外源F9的表达无法长时间较高水平维持,且所有接受AAV基因治疗的患者在治疗后都会产生对病毒衣壳特异的免疫反应,限制了同类型AAV基因治疗重复进行。是否能将缺失基因,直接插入患者基因组内,让F9因子持续表达呢?目前Sangamo therapeutics公司根据这一思路,利用基因编辑工具,将FIX基因定点插入肝脏细胞白蛋白启动子区,进行临床试验。
04切除部分致病DNA-疾病举例:DMD
假肥大型肌营养不良(DMD)是由抗肌萎缩蛋白基因(dystrophin,DMD)的致病性变异所引起的。患儿常在3~5岁发病,临床症状表现为缓慢进展的肌无力伴腓肠肌假性肥大,12岁左右丧失独立行走能力,20岁左右死于呼吸衰竭或心力衰竭。其致病基因DMD是目前已知的人类最大的基因,由79个外显子组成。由于外显子上的突变所导致整个基因失去了功能,进而导致了疾病表型。还有一种疾病贝克肌营养不良(BMD),是由于DMD基因的整码突变,仍可以表达具有部分功能的截短的抗肌萎缩蛋白,临床症状轻,生存期长。科学家们想到,是否能够通过外显子跳跃方法,截去突变区域的外显子,使得DMD患者仍然能够产生有部分功能的DMD蛋白,让“重病变轻病”。2016年,发表于科学杂志上的研究表明,利用CRISPR-Cas9 技术在DMD病人来源的iPS细胞上,切割出跨外显子45-55的725kb的缺失末端连接修复后,DMD读码框恢复,可编码具有部分功能的抗肌萎缩蛋白。这种突变的修复预计可覆盖~60%的DMD病人变异情况。2018年日本进行的基于DMD外显子45 跳跃的基因治疗phaseI/II期临床试验,目前初步结果已经显示该方法的安全性。
在很多关于安全性、有效性问题得以解决之前,基因编辑技术广泛地应用于临床,还有一段艰难的路要走。希望能在伦理规范和科学管理完善和加强的基础上,科学家们能够敬畏生命、严格遵守规则,让基因编辑技术真正给人类健康和疾病治疗带来春天!
(摘自《360个人图书馆》)