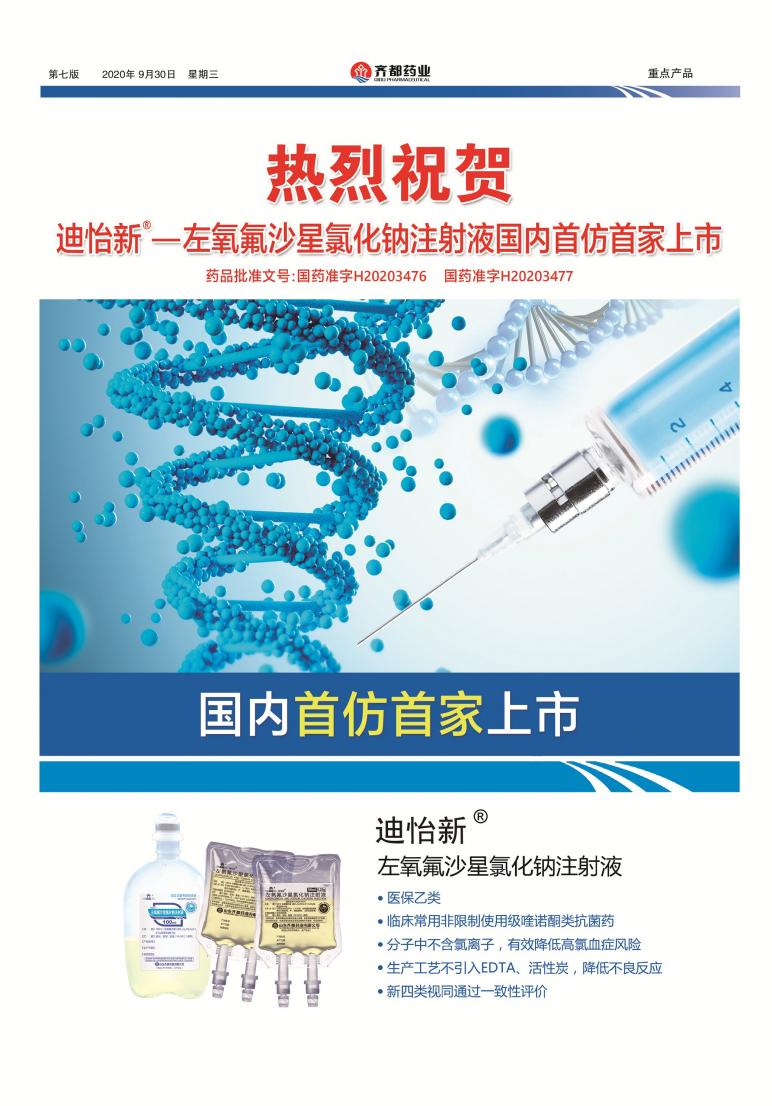
第三版:市场营销
创新工作措施 加强药物警戒管理
9月,齐都药业药物警戒与医学信息部创新工作措施,制定出台《药物警戒之沟通告知手册》。
2019年8月26日,第十三届全国人民代表大会常务委员会第十二次会议审议通过新版《中华人民共和国药品管理法》,该法第十二条规定“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制”,标志着我国药物警戒工作正式进入法制化轨道。一年来,公司药物警戒与医学信息部完善工作体系、加大工作力度、创新工作措施,不断加强药物警戒工作管理。针对部分人群药物警戒知识匮乏、安全用药知识不足、不良反应信息收集不规范以及药物警戒重视度不够等问题,制定《药物警戒之沟通告知手册》。
手册面向公司销售人员、药品经营企业和医疗机构等,包含公司简介、基本概念、相关政策、安全用药、重点产品临床使用注意事项、药品不良反应收集细则以及其他事项七个主题内容。手册的制定和使用,可以提高药品经营企业和医疗结构对MAH在不良反应监测中作用的认识和主动向MAH报告的积极性,提升销售人员不良反应知识水平和收集信息能力,深入挖掘利用药品安全性数据,全面加强公司药物警戒工作,切实履行药品上市许可持有人药物警戒主体责任,及时、有效控制药品风险,更好保障公众用药安全。